Dentale Biomaterialien (Kunstoffe, Keramiken, Metalle etc.) finden eine breite Anwendung in der Zahnmedizin. Diese Biomaterialien übernehmen Funktionen, die zuvor von körpereigenen Geweben und Strukturen wie Zahnschmelz oder Zahnwurzel erfüllt worden sind. Dabei treten diese Werkstoffe zwangsläufig in Interaktion mit den verschiedenen menschlichen Geweben, aber auch mit den über 700 verschiedenen in der Mundhöhle vorkommenden Arten von Mikroorganismen wie Bakterien und Pilzen.
Hier beginnt die Forschung unserer Arbeitsgruppe. Wir wollen verstehen warum manche Materialien mehr als andere mit Biofilmen/Plaque besiedelt werden. Weiter wollen wir solche Materialien schaffen, welche die Biofilmbildung reduzieren. Dies geschieht z.B. durch Oberflächenbearbeitungen und -beschichtungen. So können existierende Materialien verbessert oder neue entwickelt werden. Bei der Untersuchung von Materialeigenschaften stehen Charakteristika wie die Rauheit (von Rauheiten im sichtbaren Bereich bis in die Größenordnung von wenigen Nanometern) oder die freie Oberflächenenergie im Fokus.

Fungale Besiedelung von zwei Prothesenkunststoffen ohne (a) und mit antimykotischem Zusatz (b). Lebende Pilzzellen fluoreszieren grün und abgetötete Pilzzellen fluoreszieren rot. Dichter fungaler Biofilm mit vielen vitalen Zellen auf dem Ausgangsmaterial (a); dagegen gehemmter fungaler Monolayer mit vielen abgetöteten Zellen auf dem antimykotisch-modifiziertem Material.
Biofilme verursachen die allermeisten Erkrankungen in der Mundhöhle, so z.B. Karies, Parodontitis oder Periimplantitis. Die Kontrolle und Modifikation dieser Biofilme ist das Ziel vielfältiger neuer therapeutischer Strategien in der Zahnmedizin. In unserer Arbeitsgruppe untersuchen wir nicht nur gezielt den Einfluss von antimikrobiellen Wirkstoffen wie z.B. Chitosan, Nanosilber oder Kupfer auf die Zusammensetzung und das Verhalten von Biofilmen, sondern auch die Biofilmbildung und dessen Verhalten auf neuartigen Biomaterialien und ebenso deren mögliche zytotoxische (zellschädigende) Eigenschaften. Durch die Kombination von Zell-Labor (AG Orale Biologie und Geweberegeneration) und Mikrobiologie-Labor können wir die biologischen Wechselwirkung von Biomaterialien umfassend beschreiben.
Wir arbeiten hierfür eng mit allen klinischen Bereichen des Zentrums zusammen und können so Forschungsprojekte in vitro („im Glas“, d.h. im Labor) bis in vivo („im Lebendigen“, d.h. mit Probanden) durchführen. Die in-vitro-Untersuchungen im Labor können relativ schnell und mit konstanten Rahmenbedingungen durchgeführt werden. Wir können dann immer realistischere Bedingungen schaffen und neue Materialien abschließend sogar an ausgewählten Probanden testen.
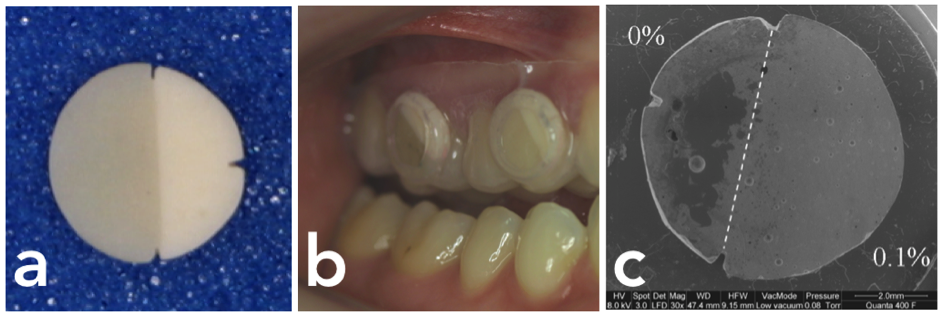
Geteilter Probekörper (a), links/dunkel der modifizierte Zement mit antibakteriellem Additiv und rechts der Orginal-Zement. In-vivo-Biofilmbildung auf dem Probekörper, eingegliedert für 24 Std. mittels individueller Schiene (b). Darstellung der Biofilmbildung via Rasterelektronenmikroskopie: Ausgangsmaterial (0%) dicht besiedelt und Zement mit Zusatz (0,1%) ohne sichtbaren Biofilm.
Ziele dieses jungen Forschungszweiges ist daher die Etablierung von Labormodellen der Mundhöhle zur genaueren Analyse der Biofilmbildung und die weitere Charakterisierung der Wechselwirkungen in vivo. Die langfristige Zielsetzung unserer Forschung ist es antimikrobielle Biomaterialien zu schaffen, die den Biofilm und damit das Auftreten von Karies, Parodontitis, Periimplantitis etc. verhindern.